Räumlicher Bau als Voraussetzung für Chiralität
Jeder hat schon einmal seine Handschuhe falsch herum angezogen: Den linken Handschuh auf die rechte Hand und umgekehrt. Das passt nicht. Unsere Hände haben zwar alle 5 Finger, auch liegt neben dem Daumen immer der Zeigefinger oder der kleine Finger liegt dem Daumen entgegengesetzt. Aber dennoch sind die Hände eben nicht deckungsgleich. Die Wissenschaft spricht von chiral, das Phänomen wird als Chiralität (griechisches Kunstwort für „Händigkeit“) bezeichnet.
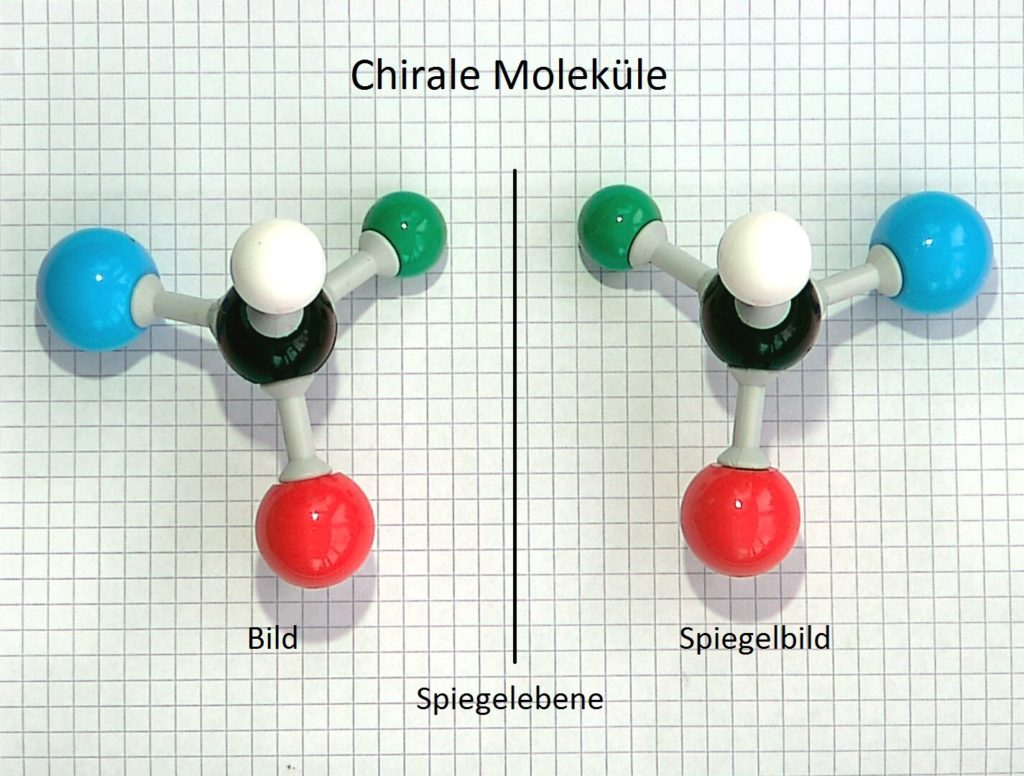
Auch bei chemischen Molekülen gibt es das Phänomen. Bei den hier dargestellten Modell-molekülen ist jeweils die mittige schwarze Kugel, das sogenannte Chiralitätszentrum, von vier verschiedenen farbigen Kugeln umgeben. Der räumliche Bau stellt einen Tetraeder dar. Die beiden Modelle verhalten sich wie Bild und Spiegelbild und lassen sich nicht zur Deckung bringen. In der Chemie werden diese Moleküle Enantiomere genannt.
Bild 1: Strukturen sind wie Bild und Spiegelbild, nicht deckungsgleich!
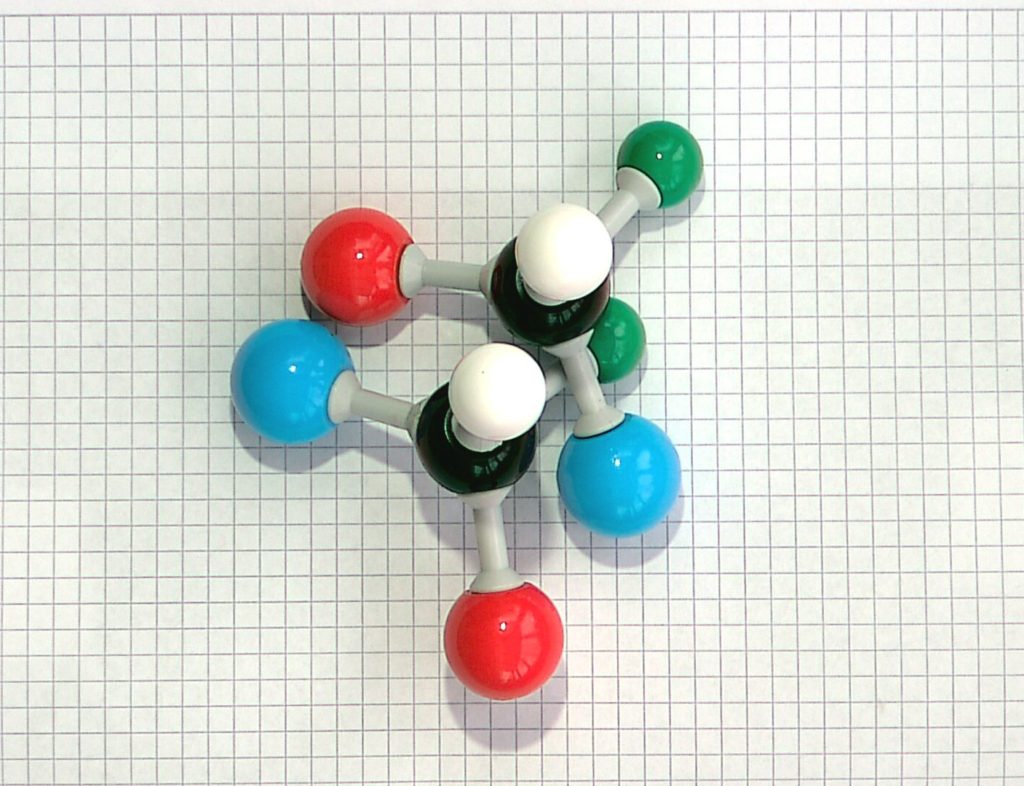
Allerdings sind nicht automatisch alle Moleküle mit vier verschiedenen Substituenten wie Bild und Spiegelbild. Liegen die Modelle so ausgerichtet, wie in Bild 2, erkennt man nicht sofort, dass die beiden Strukturen deckungsgleich sind. Es handelt sich um das „Spiegelbild“ aus Bild 1.
Übertragen auf das Einführungsbeispiel, wäre jetzt z. B. nur die rechte Hand dargestellt, zu der nur der rechte Handschuh passt.
Bild 2: Deckungsgleiche Strukturen, identische Moleküle!
Dreht man das „Spiegelbild“ aus Bild 1 um die Grün-Schwarz-Achse, so dass die weiße Kugel noch oben schaut, erhält man die Darstellung in Bild 2.
Zwei gleich Substituenten verhindern chirale Moleküle
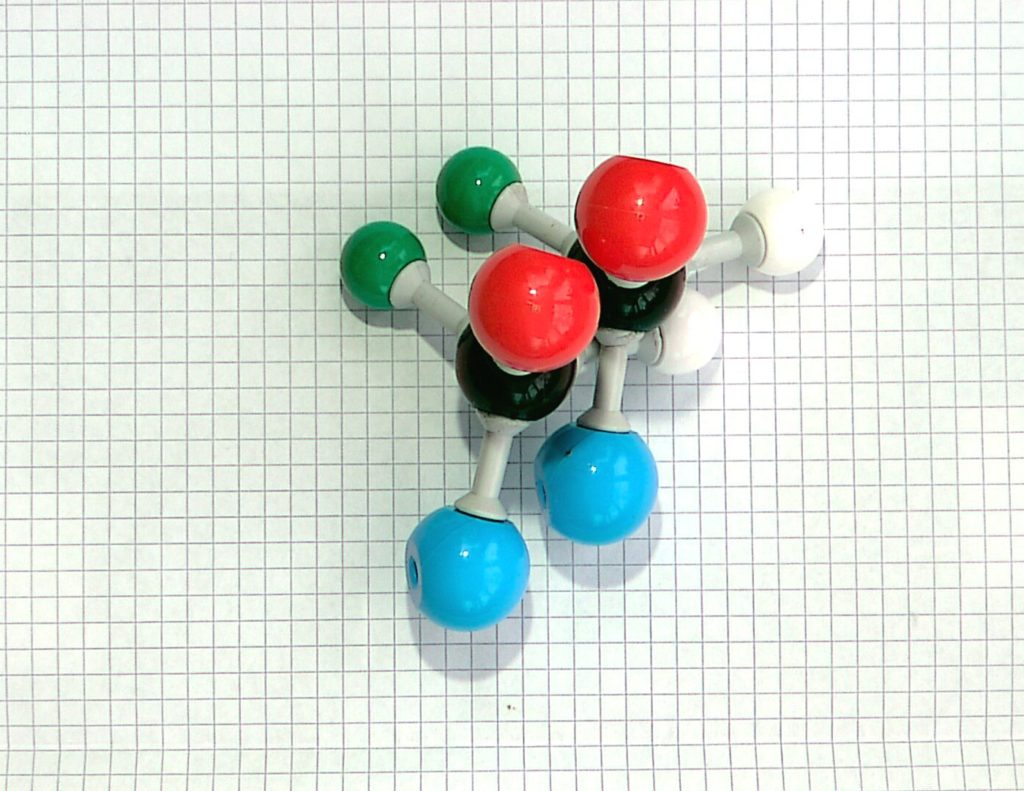
Sobald bei vier Substituenten zwei davon gleich sind, kann es keine Enantiomere geben. Diese Moleküle besitzen kein Chiralitätszentrum, sie sind nicht chiral, man bezeichnet sie auch als achiral.
Bild 3: Achirales Molekül, wenn zwei von vier Bindungspartnern gleich sind!
Stereochemische Beziehungen
Enantiomere gehören zu den Stereoisomeren, da sie gleiche Verbundenheit innerhalb des Moleküls besitzen. Am Modellmolekül aus Bild 1 oder 2 erklärt, bedeutet dies, dass eine schwarze Kugel immer mit einer blauen, einer grünen, einer roten und einer weißen Kugel verbunden ist.
Stereoisomere werden unterteilt in Konformations- und Konfigurationsisomere. Konformationsisomere sind nach Rotation um eine Einfachbindung identisch, so wie z. B. die gestaffelte und ekliptische Form von Ethan.
Stereoisomere, die nicht nach einer Rotation um eine Einfachbindung identisch sind, nennt man Konfigurationsisomere.
Konfigurationsisomere werden unterteilt in Enantiomere und Diastereomere. Enantiomere verhalten sich wie Bild und Spiegelbild, Diastereomere sind anders. Zu den Diastereomeren zählt z. B. die z/e-Isomerie an Doppelbindungen. Diastereomere treten aber auch bei Verbindungen mit mindestens zwei Chiralitätszentren auf.
Wie unterscheiden sich Enantiomere in ihren Eigenschaften?
Enantiomere besitzen die selben physikalischen Eigenschaften, z. B. wie Schmelzpunkt oder Dichte. Sie drehen linear polarisiertes Licht um den gleichen Betrag, aber in unterschiedliche Richtungen. Man spricht daher von optisch aktiven Stoffen.
Aufgrund dieses Phänomens lassen sich Enantiomere voneinander unterscheiden.
Chemisch gesehen reagieren Enantiomere gleich, außer gegenüber optisch Aktiven Stoffen, wie z. B. Enzymen.
Das Phänomen der optischen Aktivität wird in einem eigenen Beitrag erklärt.