Säurestärke als Thema im Unterricht
Unter Säurestärke versteht man, wie stark eine Säure dissoziiert ist. Das erste mal begegnet der Schüler diesem Phänomen, wenn er mit der unterschiedlich heftigen Reaktion von gleich konzentrierten Säuren gegenüber Metallen konfrontiert wird oder erklärt werden soll, warum gleichkonzentrierte Säuren unterschiedliche pH-Werte besitzen. Qualitativ wird die Säurestärke (bzw. Basenstärke) erst in der Oberstufe in Form des pKs-Wertes (bzw. pKb-Wertes) behandelt.
pH-Werte nivellieren den sichtbaren Unterschied
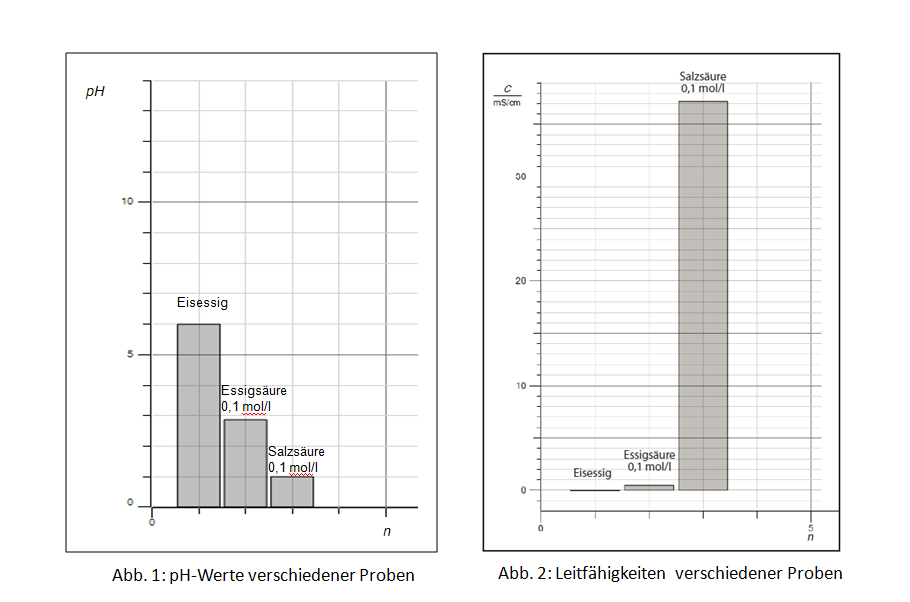
Rein optisch betrachtet kann man kaum glauben, dass der gleiche Sachverhalt (wo liegt das Gleichgewicht bei der Dissoziation einer Säure HA) mit den beiden Abbildungen wissenschaftlich gleich gut beschrieben wird.
Wer kein tieferes Verständnis des pH-Wertes vorzuweisen hat bzw. im logarithmischen Denken nicht geschult ist, wird aus der Abb. 1 eine andere Schlussfolgerung ziehen, als aus der Abb. 2. Der pH-Wert nivelliert vom Zahlenwert her die Unterschiede zwischen einer starken Säure, wie z.B. Salzsäure, und einer schwachen Säure, wie z.B. Essigsäure. Er nivelliert deshalb, da ein pH-Sprung von 1 in Wirklichkeit einem Unterschied in der Oxoniumionen-Konzentration von Faktor 10 entspricht.
Leitfähigkeit entspricht unserer visuellen Wahrnehmung
Abb. 2 zeigt deutlich, wie wenig dissoziierte Ionen bei Essigsäure im Vergleich zur gleich konzentrierten Salzsäure (jeweils 0,1 mol/l) vorliegen müssen. Der Balken für die Leitfähigkeit bei Salzsäure ist um ein vielfaches größer als bei Essigsäure. Bei der pH-Wert-Messung ist der Balken der Essigsäure nur 2,7 mal größer als der von Salzsäure. Auch das ist ein Denkhindernis: Der größere Balken ist die schwächere Säure.
Der pH-Wert von Eisessig (Essigsäure, 100 %) ist dagegen noch leicht zu erklären: Die Spuren von Wasser im Eisessig sind für den pH-Wert von 6 verantwortlich. Der pH-Wert von 6 bedeutet eine extrem kleine Anzahl von Oxoniumionen.
Schlussfolgerung für den Unterricht
Wenn das Phänomen der Säure- bzw. Basenstärke erklärt werden soll, ist es sinnvoll, zunächst mit der Messung der Leitfähigkeit zu arbeiten. Dazu ist ein Messwerterfassungssystem eine große Erleichterung.
Die Leitfähigkeit stellt die Unterschiede optisch auch so dar, dass Schüler von den unterschiedlich hohen Säulen bei Essigsäure und Salzsäure beeindruckt sind und einen Denkprozess in Gang setzen. Sie müssen nicht, wie beim pH-Wert, um die Ecke denken.
Nachdem das Phänomen Säurestärke verstanden ist, können analoge Messungen mit einer pH-Sonde erfolgen. Dadurch wird das Konzept des pH-Wertes vertieft, da schon von der Leitfähigkeitsmessung her die großen Unterschiede in der Ionenkonzentration klar sind.
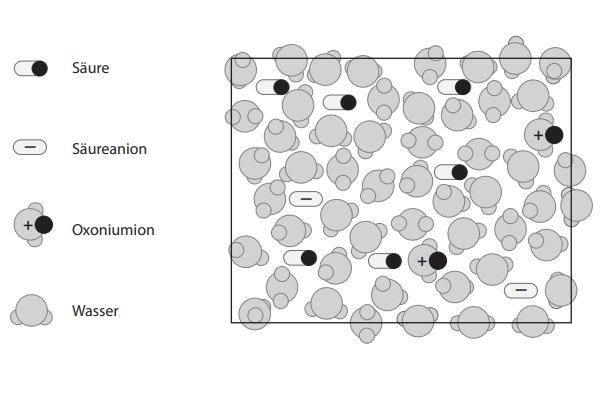
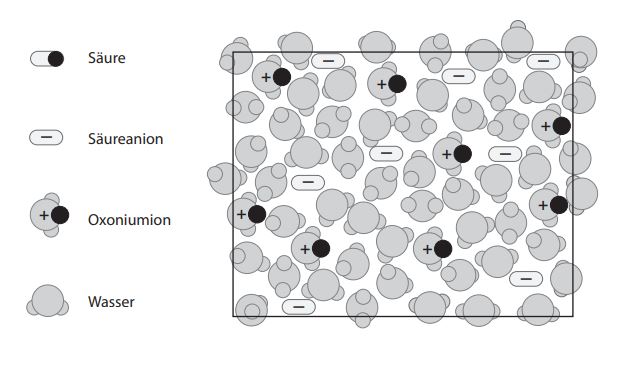
Darstellung auf Teilchenebene
Wie immer hilft eine Darstellung auf Teilchenebene, ein Konzept zu vertiefen bzw. zu verstehen. Mit den folgenden Abbildungen wird eine schwache und eine starke Säure auf Teilchenebene charakterisiert. Die Darstellungen erklären auch die Messungen aus Leitfähigkeit und pH.
Materialien
Die Versuchsanleitung zur Erstellung der Messwerte mit dem Messwerterfassungssystem CASSY findet sich unter:
Starke und schwache Säuren (Leitfähigkeitsmessung)
Die CASSY-Labx-Datei zu diesem Versuch mit den genauen Messwerten kann heruntergeladen werden (zum Öffnen ist das Programm CASSY-Lab 2 erforderlich, das zum Betrachten der Dateien ohne Lizenzcode verwendet werden kann):
CASSY-Labx: Starke und schwache Säuren (Leitfähigkeitsmessung)
Sehr informativ ist der Beitrag Explaining acid strength aus der Reihe Chemical Misconception der Royal Society of Chemistry, London:
Explaining acid strength
Die Materialien der Royal Society of Chemistry werden innerhalb dieser Webseite beschrieben unter: